来源
《中国中药杂志》2021年
作者
瞿礼萍,唐健元,张磊,杨忠奇,元唯安,王停,张永文,李耿
成都中医药大学西南特色中药资源国家重点实验室
成都中医药大学附属医院
上海中医药大学
广州中医药大学第一附属医院
上海中医药大学附属曙光医院
北京中医药大学北京中医药研究院
国家药品监督管理局药品审评中心
中日友好医院
摘要
自新中国成立以来,我国中医药发展获得了高度重视和支持,但从近年中药产业现状和注册审批情况看,当前我国中药产业仍面临较大挑战,政策的导向也直接影响了产业的高质量发展。新版《药品注册管理办法》及其配套文件“中药注册分类及申报资料要求”已于2020 年发布施行。注册分类是中药注册管理制度的核心与重点内容,直接关系到能否正向引导并促进中药的研发注册和产业的创新发展。
该文旨在系统回顾分析我国中药注册分类的历史演变过程,分析新版中药注册分类的现状及可能存在的问题,以期为有关部门后续配套文件的制定以及更好衔接、落实法律法规提供参考。
关键词
中药;注册分类;演变;问题
|
_ |
正文 |
_ |
中药是我国特有的医疗卫生与科技资源,从古至今在我国医疗保健体系中都扮演着重要角色。1984 年颁布的《中华人民共和国药品管理法》作为我国第1 部有关药品研制、生产、使用和流通管理的基本法律,首次从法律层面清晰地将中药纳入药品进行管理。自国家“九五”计划以来,我国中药产业持续快速增长,2013 年中成药生产制造子行业营业收入已达5065 亿元,占医药工业主营业务收入23.5%,仅次于化学药(26.6%)[1-2]。然而,最新国家统计局数据显示,2019 年中成药生产制造子行业营业收入降至4587 亿元,占比降为17.5%,明显低于化学药的占比(32.8%)。与此同时,近年来我国中药新药申请与批准数量亦呈持续双低的态势,2015—2017 年甚至出现新药上市申请连续零批准的现象,业界中药新药研发的积极性严重受损,中药产业面临严峻的考验[3,4]。药品监管政策是政府宏观调控医药市场的重要手段,政策与产业特点是否匹配,也直接关系着产业能否高质量发展。综观我国中药监管现状,其评价与注册标准长期机械移植化学药品思路是当前中药产业发展受阻的重要原因[5]。因而,2017 年国家“关于深化审评审批制度改革鼓励药品医疗器械创新的意见”明确提出“建立完善符合中药特点的注册管理制度和技术评价体系”,2019 年《中华人民共和国药品管理法》、2020 年《药品注册管理办法》均进一步做了强调[6],其重要配套文件“中药注册分类及申报资料要求”也于2020 年9 月发布。注册分类是历版中药注册管理改革的重点之一,亦是屡受诟病的核心问题[7,8]。
本文以此为切入点,旨在系统回顾我国实施药品注册管理制度以来中药注册分类的历史演变过程,分析目前新的中药注册分类存在的问题,以期为有关监管部门和同行提供参考。
1
我国中药注册分类的历史演变过程
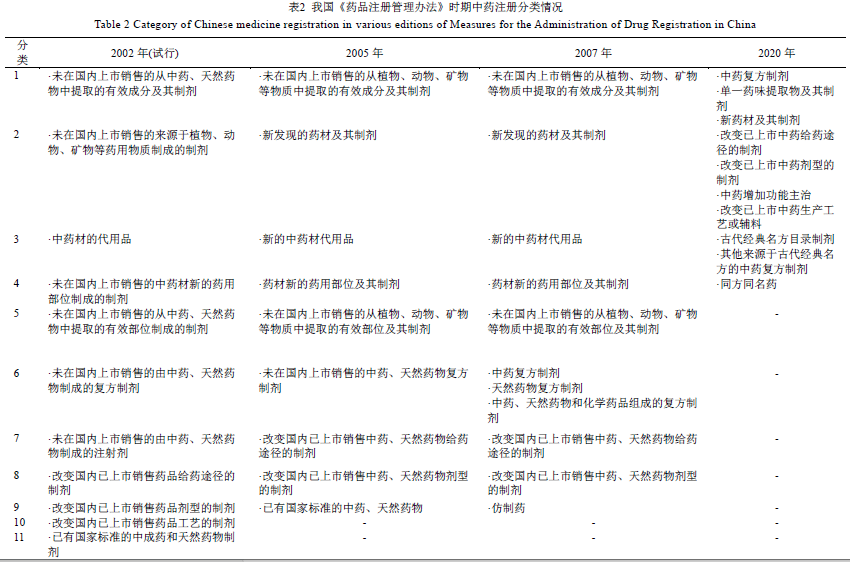
我国中药注册管理历经1985 年和1999 年2 版《新药审批办法》以及2002 年、2005 年、2007年、2020 年这4 版《药品注册管理办法》试行或正式施行版本。中药注册分类经历了多次变革,见表1、2。
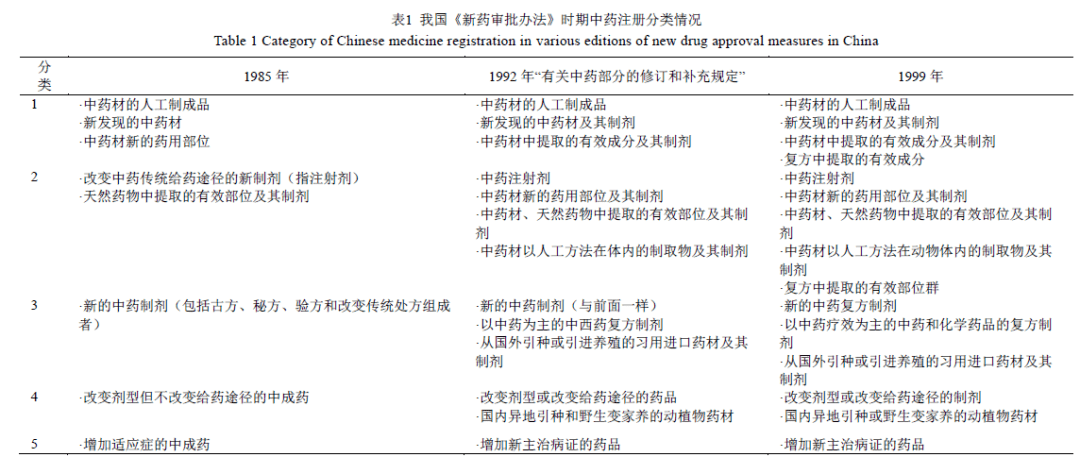
1.1《新药审批办法》时期(1985—2002 年)
我国分类注册管理中药最早见于1985 年原卫生部颁布的《新药审批办法》,分为5 类。第1 类为“中药材的人工制成品、新发现的中药材、中药材新的药用部位”;第2 类为“改变中药传统给予途径的新制剂、天然药物中提取的有效部位及其制剂”,前者为注射剂;第3 类为“新的中药制剂(包括古方、秘方、验方和改变传统处方组成者)”;第4 类为“改变剂型但不改变给药途径的中成药”;第5类为“增加适应症的中成药”。1987 年出台“《新药审批办法》有关中药问题的补充规定和说明”对各类别予以说明;1992 年进行了修订和补充规定,在第1 类中药中新增“中药材中提取的有效成分及其制剂”,并将新药用部位调至第2 类,在第2 类中明确提出“中药注射剂”,第3 类中新增“中西药复方制剂”,并分别在第3 类和第4 类新增“从国外引种或引进养殖的习用进口药材及其制剂”和“国内异地引种和野生变家养的动植物药材”。1998 年国家组建原国家药品监督管理局(SDA),1999 年颁布新的《新药审批办法》(局令第2 号),新药被明确定义为“我国未生产过的药品”,中药注册仍分为5类,且均按新药管理,主要在前述第1、2 类中新增“复方中提取的有效成分”、“复方中提取的有效部位群”。
总体而言,在上述《新药审批办法》期间的中药注册分类有2 大特点,一是十分重视药材资源;二是在其实施过程中逐步形成了有效部位、有效成分类中药制剂及中药注射剂的概念,中西药复方制剂这类特殊中药制剂也在此阶段产生。这与20 世纪60、70 年代我国经历中草药运动以解决农村缺医少药问题有关,在这期间普及推广中药研发与运用的过程中已意识到药材资源的重要性,中药科研、中成药制剂开发应用等方面也取得了突出成果[9]。此外,1999 年《新药审批办法》明确提出有效部位或成分可来自复方,也为组分配伍中药新药的研发提供了注册路径,引起了业界对名优中成药二次开发的热潮[10]。
1.2《药品注册管理办法》时期(2002—2020 年)
随着 2001 年《药品管理法》修订,2002 年《药品注册管理办法》(简称《办法》)(试行)(局令第35 号)替代了《新药审批办法》,第1 次明确了药品注册的概念,中药分类也从原5 类增至11 类。有效成分类制剂被调整为第1 类,新的中药材调为第2 类,中药材代用品、药用部位分别为第3、4 类,有效部位类制剂为第5 类,中药复方制剂为第6 类,第7~11 类中药分别为中药注射剂、改变给药途径、改变剂型、改变工艺及已有国家标准中药;其中,前10 类均属新药。同时,中国正式加入世界贸易组织(World Trade Organization,WTO)后,也逐渐对药品注册管理提出新的要求。在此背景下,《办法》(局令第17 号)于2005 年正式施行,修订了2002 年《办法》(试行)中与WTO 规定冲突的内容,中药注册分类的变化主要为取消原第7 类“未在国内上市销售的中药注射剂”,以及将原第10 类“改变国内已上市销售药品工艺”的情形纳入补充申请。因而,2005 年《办法》的中药注册分类调整为9 类,前8 类按新药管理,这也基本形成了我国近10 余年来以药学物质基础为核心的中药注册分类模式的雏形。同时,由于中药新药门槛过低,尤其规定改剂型中药若无质的改变可减免临床研究,已有国家标准中药制剂只要符合国家标准即可减免相关研究[11],造成大量低水平重复和注册申请积压。因而,2007 年《办法》(局令第28 号)提高对新药的要求,将新药规定为前6 类,将第9 类“已有国家标准的中药、天然药物”改为“仿制药”。相较以往药品注册法规的频繁变更,在这以后我国药品及中药注册管理进入相对稳定的时期。
在 2007 年《办法》实施13 年后,新版《办法》(国家市场监督管理总局令第27 号)于2020 年颁布实施。《办法》不再仅以药学物质基础作为划分注册类别的依据,而是强调遵循中医药发展规律,以临床价值为导向,在鼓励创新研制及二次开发的同时,亦加强重视古典医籍精华的梳理和挖掘,以促进中药传承发展[12];将中药的注册分类总体上由9 类简化为4 类,即中药创新药、中药改良型新药、古代经典名方中药复方制剂及同方同名药。2020 年新《办法》的施行,标志着我国中药新药注册管理进入全新发展时期。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
2
我国中药注册分类的现状
我国目前的中药注册分为4 类,前3 类均为新药,见表2。
第 1 类为中药创新药,系指处方未在国家药品标准、药品注册标准及国家中医药主管部门发布的《古代经典名方目录》中收载,具有临床价值,且未在境外上市的中药新处方制剂;包括第1.1 类“由多味饮片或提取物组成的复方制剂”、第1.2 类“从单一植物、动物、矿物等物质中提取得到的提取物及其制剂”及第1.3 类“新药材及其制剂”。
第 2 类为中药改良型新药,指改变已上市中药的给药途径、剂型,且具有临床应用优势和特点,或增加功能主治等的制剂;包括第2.1 类“改变已上市中药给药途径的制剂”、第2.2 类“改变已上市中药剂型的制剂”、第2.3 类“中药增加功能主治”和第2.4 类“已上市中药生产工艺或辅料等改变引起药用物质基础或药物吸收、利用明显改变的”等4 种情形。
第 3 类为古代经典名方中药复方制剂,是指来源于符合《中华人民共和国中医药法》规定,至今仍广泛应用、疗效确切、具有明显特色与优势的古代中医典籍所记载方剂的中药复方制剂;又细分为第3.1 类“按古代经典名方目录管理的中药复方制剂”和第3.2 类“其他来源于古代经典名方的中药复方制剂”。
第 4 类为同方同名药,指通用名称、处方、剂型、功能主治、用法及日用饮片量与已上市中药相同,且在安全性、有效性、质量可控性方面不低于该已上市中药的制剂。
3
我国现行中药注册分类存在的问题
3.1“新的中药材代用品”缺位,不利于保障药材来源稳定和中医药可持续发展
相比 2007 年《办法》,目前的中药注册分类做出了较大调整,尤其将原第1、5、6 类中药均纳入第1 类中药创新药,规定饮片、提取物均能作为处方药味,不再要求有效部位或成分的含量,是新版《办法》的重要创新改革举措。但从药材资源的角度,目前第1.3 类“新药材及其制剂”中,仅保留了原第2 类“新发现的药材及其制剂”和原第4 类“药材新的药用部位及其制剂”,“新的中药材代用品”未在其中。中药产业以自然资源为主要原料,中药材代用品是解决一些疗效肯定、在临床不可或缺的珍稀保护品种资源稀缺、保护濒危物种的有效措施,可以是开发的新药用资源或中药材的人工制成品。早在1985 年《新药审批办法》时期,我国已将中药材的人工制成品作为第1 类中药管理,在2002、2005 和2007 年版的《药品注册管理办法》改称为“新的中药材代用品”,属第3 类中药。尽管该注册路径已有35 年时间,至今也仅有人工麝香、体外培育牛黄等少数中药材代用品获批,2007 年《办法》实施13 年间更无1 新的品种批准上市[3],这与代用品与原药材之间相似性评价的技术难度大不无关联,但同时也提示了中药注册技术要求与产业和研发实际出现了不匹配的问题,评价思路和方法也就缺乏前瞻性。当前中药注册监管改革不宜忽略,应正视该问题。
2020 年12 月“关于促进中药传承创新发展的实施意见(国药监药注〔2020〕27 号)”在“加强中药质量源头管理”中明确提出保护野生药材资源,严格限定使用濒危野生动、植物药材,以保障中药材来源稳定和资源可持续利用[13]。该实施意见的精神旨在针对当前我国野生中药材资源严重破坏[14]的问题,保护濒危药材和生物多样性,保障药材来源稳定。新的中药材代用品对此具有重要意义,也是确保中医药可持续发展的重要措施。同时,2017 年获批开展临床试验的原第3 类中药“人工熊胆粉”在目前注册分类缺失“新的中药材代用品”的情况下,也存在法规延续性的问题。可见,新的中药注册分类出现中药材代用品的缺位并不合理。
3.2 第2.4 类中药改良型新药在一定程度忽略了中药的物质特点,且易与变更注册混淆
2015 年国务院“关于改革药品医疗器械审评审批制度的意见(国发[2015]44 号)”发布后,我国启动最新一轮药品注册分类改革工作,2016 年首先对化学药品分类做出了调整[15]。规定新药为“全球新”,并根据原创性程度的不同分为创新药和改良型新药。后者强调“优效性”,是在已知活性成份的基础上,对结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品[16]。这借鉴了美国505(b)(2)途径思路,可通过桥接研究援引已上市新药的安全与有效性数据,而无需再开展完整临床试验研究,如艾司奥美拉唑干混悬剂、艾司奥美拉唑锶缓释胶囊则是对已上市药品改剂型、改盐的改良型新药[17]。改良型新药的设计可避免重复研究、提高研发效率,也有助于遏制低水平重复。
目前第2 类中药的4 种情形,基本借鉴了该思路,对合理引导已上市中药的研究有一定积极作用。但实质上,改良型新药的监管思路是以化学药品明确均一的药用物质基础和相对清楚的作用机制为出发点,而中药多来自于天然药材,依赖于复杂的有效物质群,临床作用机制复杂,与化学药品的理论体系有本质区别。对于第2.4 类改变已上市中药生产工艺或辅料的情形,在活性成份与非活性成份均不清楚的情况下,一般的生产工艺或辅料变化是否对中药“药用物质基础或药物吸收、利用”产生明显改变,是难以判断的问题;即使对中药物质基础产生影响,但其是否一定带来临床疗效和安全性的显著变化,亦不能以化学药品为参考标准。分析美国对这类情况的规定可以发现,在对药品安全性、有效性不产生不良影响的情况下改变参比制剂(reference listed drug, RLD)处方中非活性成份是505(j)仿制药简化新药申请途径允许的情形,505(b)(2)注册路径中改变RLD 制剂处方的情况实质强调的亦是对临床安全性和有效性产生的影响[18]。因而,第2.4 类中药的规定在一定程度上忽略了中药与化学药品完全不同的理论体系和物质基础特点。
此外,2020 年《办法》增设药品上市后变更注册,规定持有人应主动开展上市后研究,对需改变原注册批准事项的情形(包括改变生产工艺或辅料)进行变更申请,并根据变更事项对药品安全性、有效性和质量可控性影响的程度,分重大、中等和微小变更[19]。中药改良型新药实质上也是对已上市药品的改进,第2.4 类的情形亦容易与生产工艺、辅料变更,尤其是重大变更产生混淆。同时,由于企业自身难以判断其希望进行的变更属于改良型新药申请还是变更申请,这也给企业上市药品变更研究的立项带来了较大困难。
3.3 第3 类“古代经典名方中药复方制剂”与创新药、同方同名药的关系有待厘清
古代经典名方中药复方制剂在目前的注册分类为第3 类中药,除了2008 年“中药注册管理补充规定”提及的,即现第3.1 类“按古代经典名方目录管理的中药复方制剂”外,新增了第3.2 类“其他来源于古代经典名方的中药复方制剂”,均作为新药管理,并减免药效学和临床试验研究。这丰富了第3类中药的范围,也有利于促进古代经典名方的转化应用和中药传承发展。基于抗击新型冠状病毒肺炎疫情“三方”开发的清肺排毒颗粒、化湿败毒颗粒和宣肺败毒颗粒,则是以第3.2 类在较短时间内获批上市。然而,“中药注册分类与申报资料要求”规定第3.2 类包括了未按古代经典名方目录管理的古代经典名方和基于古代经典名方加减化裁的中药复方制剂。根据《中华人民共和国中医药法》,古代经典名方是指至今仍广泛应用、疗效确切、具有明显特色与优势的古代中医典籍所记载的方剂。辨证论治下的加减化裁是中医临床处方用药的重要特点,第3.2 类中药的情形在当代中医临床是极为常见的。从处方创新角度来看,这类情形除第3.2 类中药外,也可以选择按中药创新药第1.1 类进行申报。这2 类同为新药,可能直接导致企业研发与注册往第3.2 类去引导,研发会倾向于相对低技术门槛的问题,这不符合当前药品监管改革鼓励中药创新研制的初衷,也不利于国家推动中医药传承创新思想的落实。
此外,目前我国对新药的规定强调为境内外均未上市的药品。第3.1 类“按古代经典名方目录管理的中药复方制剂”,属于目录管理,只要按照有关部门制定的“目录”进行生产,则可按此类别注册申报。一方面,目前“目录”尚需在处方组成、各药味剂量、用法用量、功能主治等方面进行深入考证和进一步规范,在不良反应、禁忌和注意事项等方面也应有所限定等[20]。另一方面,此类情形若属首家上市,是符合我国对创新药定义的,但后续提出的同一古代经典名方制剂的上市申请,该视为创新药或是同方同名药则存在自相矛盾的问题。
3.4 第4 类“同方同名药”的内涵有待优化
“同方同名药”是目前中药分类当中提出的全新称谓,从表1 和表2 可见,这是2002 年《办法》(试行)至2007 年《办法》逐步演变而来。在2002 年《办法》(试行)至2005 年《办法》期间,这类中药被称为“已有国家标准的中成药和天然药物制剂”,只要符合国家标准即可减免相关研究,准入门槛低,也直接导致了业内严重的低水平重复现象。针对该问题,2007 年《办法》参照化学药品仿制药的定义,提出“中药仿制药”概念,提高要求为“应与被仿制药品的处方组成、药材基原、生产工艺(包括药材前处理、提取、分离、纯化等)及工艺参数、制剂处方保持一致”[12],有效遏制了低水平重复申请。但如前所述,中药与化学药品存在本质区别,除了有效成分类中药制剂,绝大部分中药无法做到与被仿制药品物质基础的一致[21],中药一致性的含义也就完全不同于化学药品,不应要求物质完全一致。因而,目前强调“同方同名药”不简单等同于以往的中药仿制药,不再规定药材基原、生产工艺等必须一致,提出“功能主治、用法及日用饮片量与已上市中药相同,且在安全性、有效性、质量可控性方面不低于已上市中药的制剂”,这是合理的。
但是,同样也在一定程度忽略了中药自身的特点,基于中药成分及相关知识的复杂性和特殊性,中药与化学药品的知识产权保护程度也是完全不同的。尽管中药是我国少有的拥有原创优势的领域,但包括处方、炮制工艺等大量原创知识早已成为公共知识,这与现有知识产权制度对新颖性、创造性的要求是冲突的。目前最主要的已上市中药产品,即原第6 类中药复方制剂的开发主要源自临床实践,在上市前已有丰富的人用经验和基础[3],这类产品在现有知识产权制度下很难如化学药品获得全面有效地保护。加之,中药显效依赖于复杂的物质群,一定范围的处方或工艺变动可能对其临床疗效及安全性的实际影响并不明显,这是中药与化学药品截然不同的特点;因而,中药复方制剂的处方(组合物)专利,常可通过加减化裁予以规避,中药产品的制备工艺专利同样可通过适当地调整或改变工艺参数进行规避,这些都是中药特点与现有知识产权制度不相适应的体现。同时,知识产权制度是19 世纪末20 世纪初由西方引入的制度,我国企业尤其中药企业以往对知识产权保护的意识和能力均不足,有学者统计1996—2015 年中成药相关专利情况[22]发现,尽管数量庞大,但有效发明专利比例仅16.59%,失效专利达44.29%,这提示中成药专利质量普遍不高,而且许多失效发明专利的技术方案又进一步成为了现有技术。可见,在当前中药知识产权保护不足的情况下,较大程度地降低“同方同名药”研制要求,较多的独家生产品种或将面临低门槛“被仿制”的风险。前述中药改良型新药同样存在该问题,独家品种通过改剂型、增加适应症,以及改变工艺或辅料可能较易“被改良”。这些制度瑕疵可能会影响原研企业的创新积极性,制约中药新药创新发展,甚至再次陷入低水平重复的问题,不符合当前国家对中医药传承与创新并重发展的总体思路。如何平衡中药创新药、改良型新药和同方同名药3 者之间的关系值得考量,需要在后续配套文件中予以考虑。
4
结语
自 2017 年国家“关于深化审评审批制度改革鼓励药品医疗器械创新的意见”以来,药品主管部门一直在积极探索如何建立完善符合中药特点的注册管理制度和技术评价体系。目前新的中药注册管理制度在尊重中药研发规律、突出中药特色、体现传承与创新并重等方面,提出了一系列前所未有的改革措施,初见成效。但从本文的分析来看,目前新的中药注册管理制度仍有较大完善空间,在中药创新药、中药改良型新药、古代经典名方中药复方制剂和同方同名药方面,均存在需要后续配套文件予以补充完善的问题。2021 年1 月国务院办公厅印发“关于加快中医药特色发展若干政策措施的通知”[22]亦指出,中医药改革发展虽然取得较好成效,但仍存在诸多问题,完善中药分类注册管理,优化中药审评审批,提高中药产业发展活力,依然是当前国家有关主管部门的重点任务。中药是我国具有原创性优势的科技领域,中药监管也是我国药品监管领域中最具有开创性的工作,国际监管机构能够提供的有效参考信息十分有限。因而,国家有关部门和业界应进一步思考中药研发的内在特点与规律,在后续配套文件中更好地衔接、落实法律法规的规定,完善目前的中药注册管理制度,切实发挥政策对中药产业的良性导向作用,让中药监管成为引领国际的中国“名片”。




















 渝公网安备 50023602000365号
渝公网安备 50023602000365号